摘要
在纳米材料领域,原子级精度的金属纳米团簇(AuNCs)因其独特、稳定且高度可调控的光学性质备受关注。本文,研究人员讨论了AuNCs 产生 NIR-II 发射的机理,血管成像以及硬、软组织成像中的应用。此外,还总结了AuNCs 在肿瘤治疗诊断领域中的蕞新应用、光学性质的改进空间、临床转化中持续存在的挑战等。
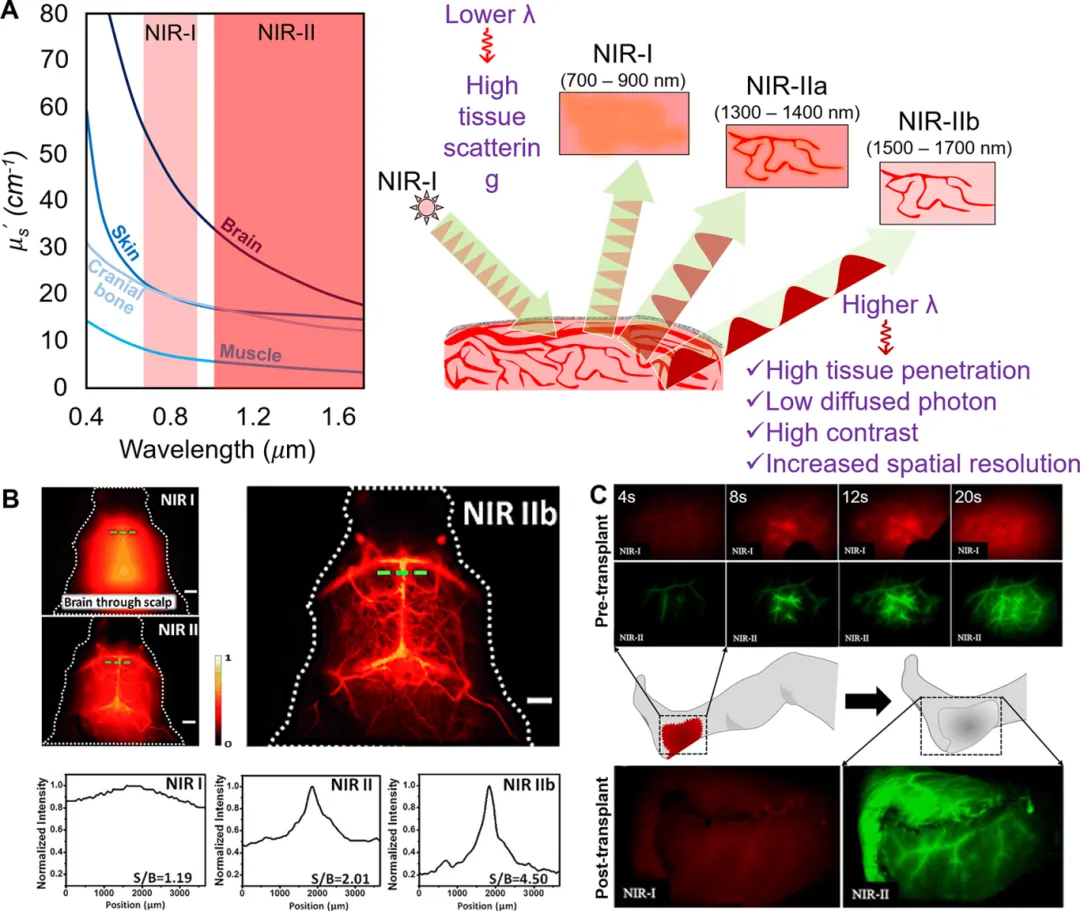
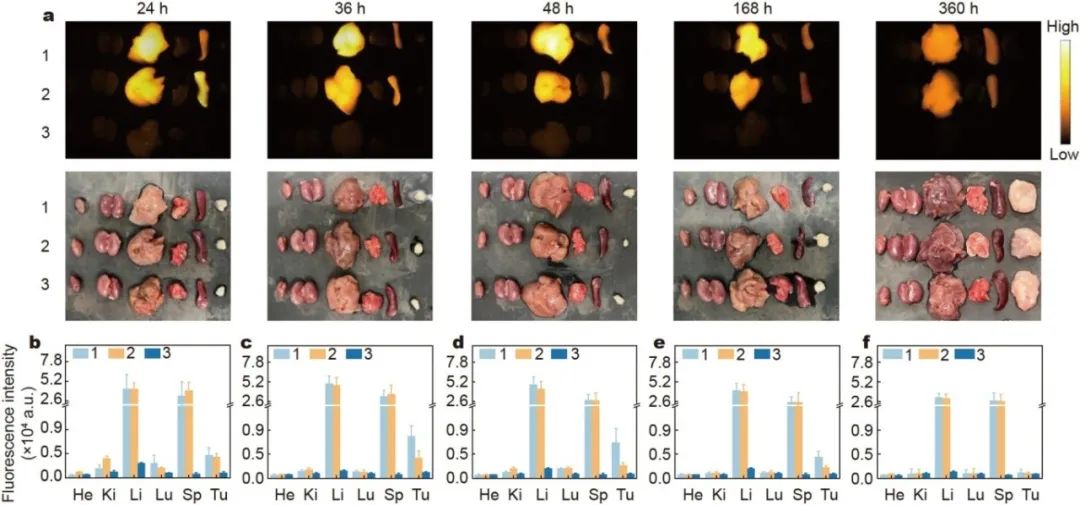
图 1. (A)在NIR-II不同组织散射系数显著降低;(B)未开颅小鼠脑血管的NIR-I、NIR-II(1000 - 1700nm)以及NIR-II b 区荧光成像以及相应的信噪比;(C)在NIR-II成像下对创口进行术前检查,界定血管损伤的范围。
AuNCs的制备
原子精度受多种因素影响,制备 AuNCs 需要严格控制反应条件。合成方法有化学蚀刻法、光还原法与化学还原法,湿化学法是先将 Au(III)还原为 Au(I),再还原为 Au(0)。生物和合成大分子可作为模板促进 AuNCs 合成,含硫醇配体的物质可合成NIR-II发射的AuNCs。GSH常用于封端配体,通过连续蚀刻形成Au₂₅(GS)₁₈,荧光波长在600 -1450nm,覆盖了NIR-I和NIR-II的窗口范围,生物相容性与肾清除率良好,还可通过核工程或配体设计使 QY提高12%。
NIR-II 窗口中的体内成像
在本节中,研究人员重点介绍使用 AuNCs 作为造影剂或标记探针在体内成像取得的进展。光学成像极具潜力,它能够以非侵入性的方式精准获取体内正在发生的各类生物过程的相关信息。
3.1脑成像
在NIR-II 成像下,小鼠左脑中的动脉血管影像更清晰。与正常小鼠相比,经LPS 损伤的小鼠体内的AuNCs 在脑中的滞留时间更长、脑动脉血流灌注更慢(图 2B)。在肾脏中检测到AuNCs 48h后依 然存在,这说明AuNCs具有无毒性的肾清除潜力。此外,使用镉掺杂的双短硫醇配体(MHA = 6 - 巯基己酸,MPA = 3 - 巯基丙酸)保护的Au₇Cd₁ - MHA/MPA用于脊柱、后肢血管和脑血管的体内成像。制备的纳米团簇有诊断和跟踪脑血管疾病的潜力。
NIR-II 成像显示 Au₇Cd₁ - MHA/MPA 在肢体血管中的早期脑灌注和长期滞留有助于实时监测血管疾病(图 2C(i - ii)),并且如图 2D 所示,信号在超过 125 min内保持高信噪比。全身成像表明纳米团簇的排泄途径主要通过泌尿系统(图 2C(iii))。
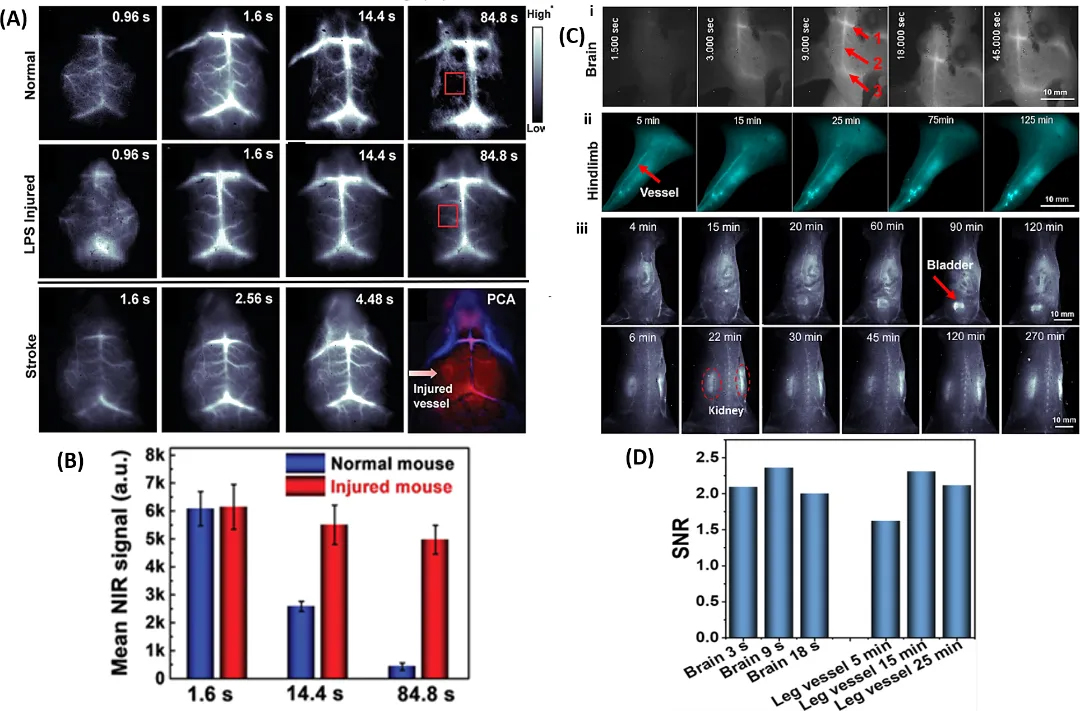
图 2. (A)健康小鼠、LPS损伤小鼠、中风小鼠的NIR-II动态脑成像以及主成分分析(PCA),叠加图像显示左脑存在显著的损伤信号。红色方框表示健康小鼠和 LPS 损伤小鼠随时间变化的定量脑信号。(B)健康小鼠和 LPS 损伤小鼠随时间变化的定量脑信号。(C)利用AuNC对脑部(i)和腿部(ii)血管进行动态成像,以及其在肾脏和膀胱中的分布情况(iii)以体现肾清除情况。箭头所指分别为:1 - 大脑下静脉、2 - 矢状窦、3 - 横窦。(D)与(i)和(ii)相对应的脑部及腿部血管的SNR
3.2血管成像
新一代的AuNCs由巯基己酸和四(乙二醇)二硫醇作为共配体进行稳定,发射波长突破1250nm。使用AuMHA/TDT NCs进行NIR-II实时可视化血管网络成像,能准确识别Bmp9 - KO小鼠中的血管疾病。在此过程中,研究人员采用蒙特卡罗约束恢复(MCR)方法进行采集后处理,将空间分辨率提高了约 59%,对比度提高了1个数量级(图 3A)。
原始图像经过 MCR 处理,进行Frangi 滤波和分割操作,进而用于血管网络映射(图3B)。WT和Bmp9 - KO小鼠在皮肤血管方面存在明显差异,可以对二者进行区分(图 3C )。此外,水溶性的 AuNCs采用两性离子LA - 磺基甜菜碱配体进行封端,具备良好的血管分辨率(图 3(D,E))。
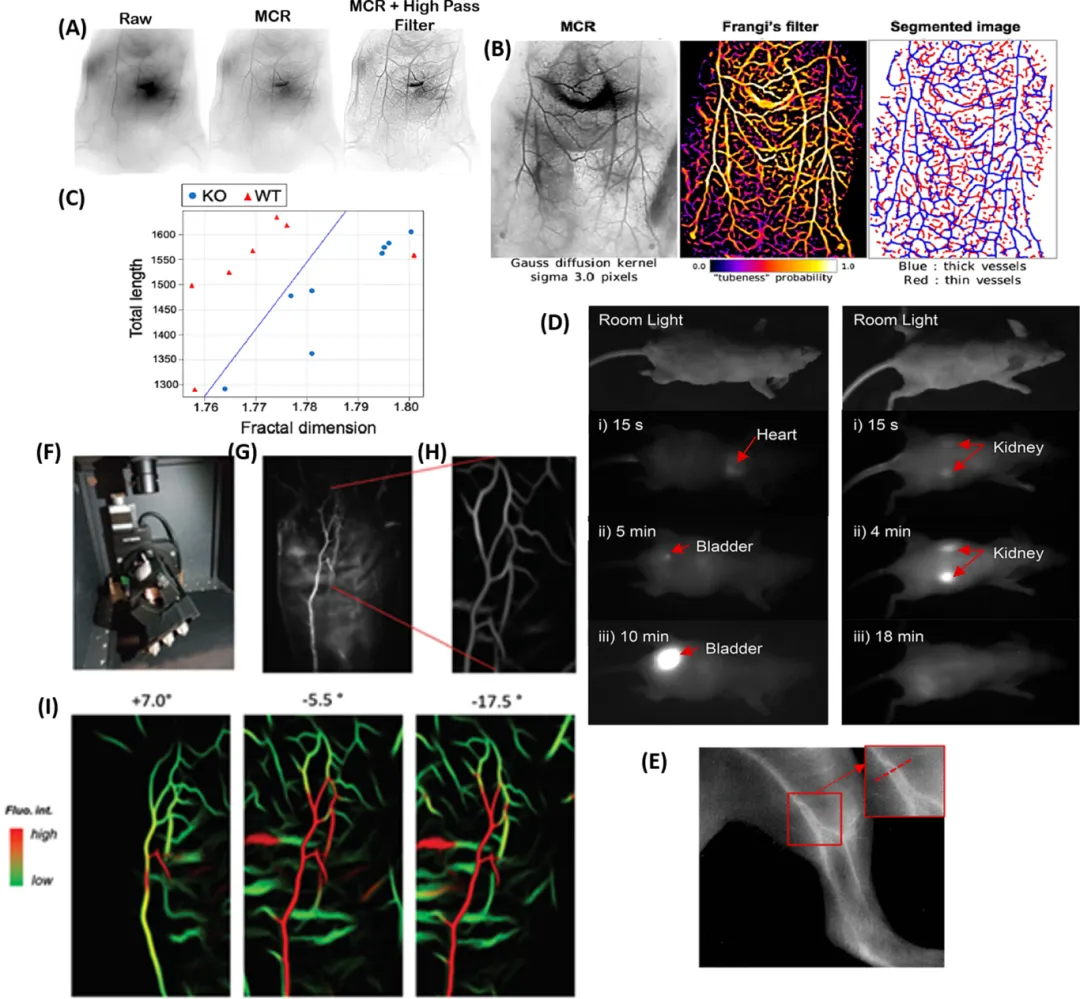
图 3. 血管的三维成像。(A)小鼠血管在蒙特卡罗图像处理前后的体内NIR-II成像(反转对比度)。(B)对一只 Bmp9-KO 小鼠进行MCR处理、Frangi 滤波以及分割后的NIR-II图像。(C)对WT小鼠和 Bmp9-KO 小鼠进行的血管长度随分形维数变化的统计分析。(D)注射AuNCs后,小鼠前后侧在不同时间点的NIR-II图像。(E)使用带有 1250 LP滤镜的InGaAs相机进行的体内血管NIR-II成像。(F)用于3D的SWIR体内成像装置。(G)对灌注小鼠进行的全尺寸SWIR成像,以及(H)经深度学习处理后的图像。(I)不同角度展示了组织和血管中不同的信号水平。经过分割且放大倍数更高的血管网络呈现出血管的伪三维定位。
研究人员开发了一种NIR-II成像系统,旨在从多视角采集NIR-II 发射AuNCs的小鼠的荧光图像,采用深度学习重建伪3D 图像(图 3(F - H))。同时,通过合理选择信号阈值,确保仅呈现血管的影像,排除周围组织的荧光干扰(如图 3I 所示)。
3.3肾脏检测和肾脏损伤
AuNCs 具有在肾脏中高效蓄积的特性,可以精准地对肾脏进行成像,可用于诊断结石、囊肿和急性肾衰竭等疾病。研究人员将铜掺杂的AuNCs(Au₂₁Cu₁),注入患病小鼠的肾脏和膀胱中, 120min后荧光信号仍然活跃,通过NIR-II显微镜可以观测到肾脏损伤。研究人员将镉原子掺杂的AuNCs(Au₂₄Cd₁)监测 AKI 损伤后72h的进展情况,这说明可以对疾病不同阶段进行长期监测(图 4(A - C))。
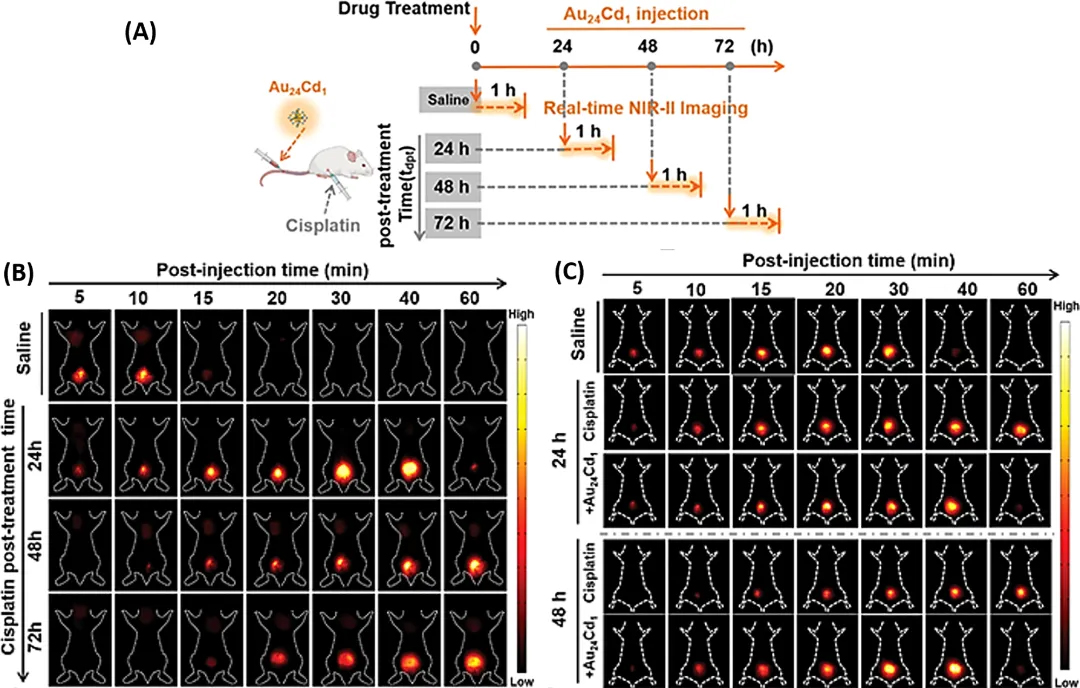
图 4. 药物诱导的肾损伤动态成像。
MHA/Cystm - AuNCs用于识别单侧输尿管梗阻(UUO)和肾缺血再灌注(RIR)诱导的肾功能障碍(图 5(A,B))。通过NIR-II窗口可以看到随着图像采集时间的增加,缺血肾脏的信号 - 背景比逐渐大于非缺血肾脏(图 5C)。这些 AuNC 可以区分不同结扎时间对肾脏的影响,证实了它们在诊断肾脏疾病方面的潜力。

图 5. 单侧输尿管梗阻(UUO)和肾缺血再灌注(RIR)所致肾功能障碍的成像。(A)肾缺血再灌注(RIR)小鼠以及(B)单侧输尿管梗阻(UUO)且输尿管结扎的小鼠在静脉注射MHA/Cystm-AuNCs后不同时间点的情况。(C)在AuNCs处理 5 min后,不同结扎时间下荧光成像的信号与背景比值(SBR)。
3.4骨成像
通常骨组织成像使用PET-CT和MRI等传统模态,但这些不能用于常规的术中追踪。基于NIR荧光引导手术(FGS),研究人员通过 Au₂₅SG₁₈展现了骨靶向 NIR-II 荧光引导手术可行性。该探针优先在骨和脊柱的羟基磷灰石上积累,随着 AuNCs 的快速清除,来自其他器官的干扰减少,骨内谷胱甘肽封端的 Au₂₅团簇荧光信号就会逐渐增加(图 6(A、B))。这表明了硬组织光学成像在临床具有巨大潜力,同时也仍具挑战。
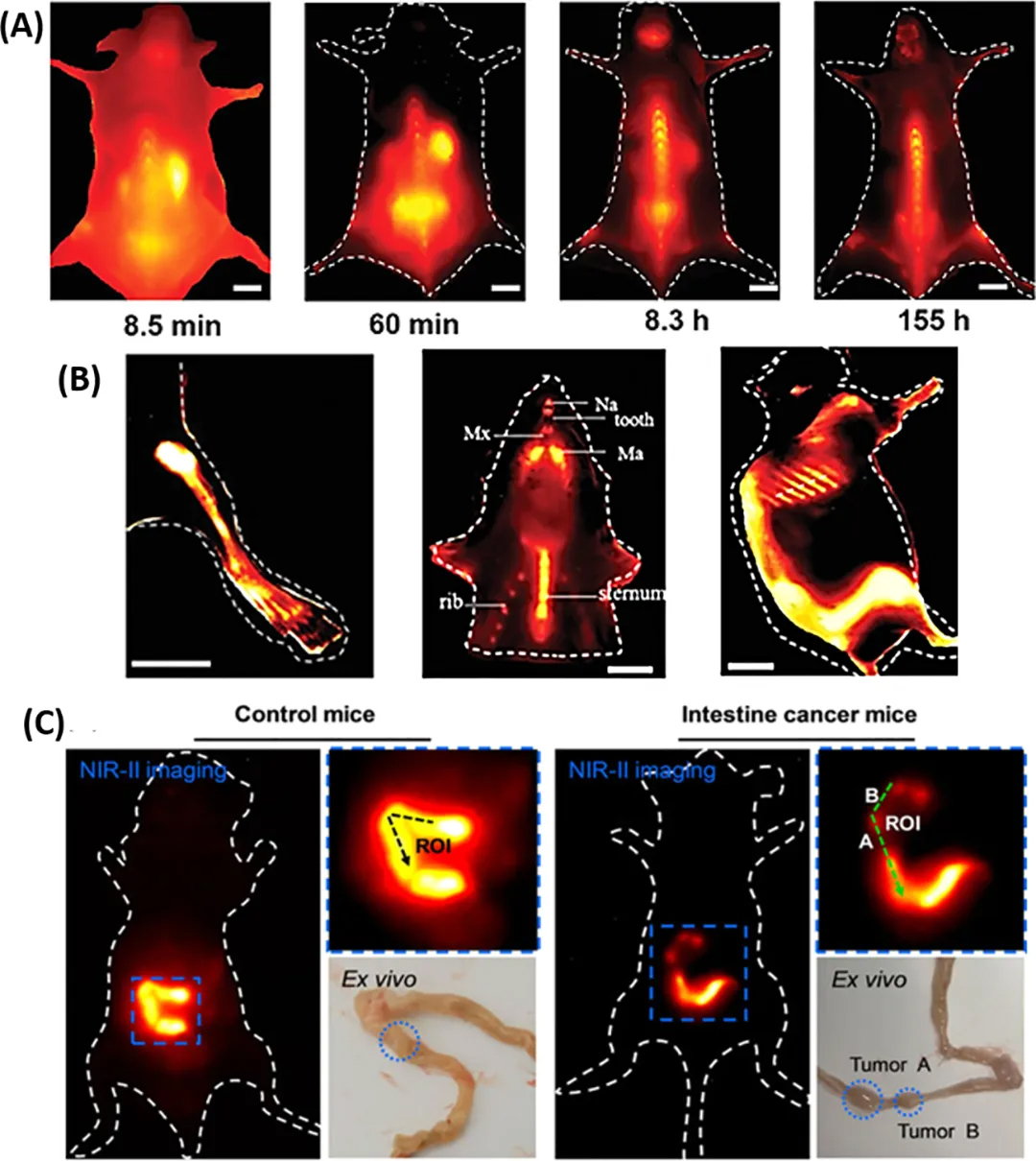
图 6. 骨骼与胃肠道成像。(A)静脉注射AuNCs后,立即对特定骨骼进行的NIR-II体内荧光成像。(B)清晰呈现后肢、下颌骨、上颌骨、鼻骨、胸骨和肋骨的影像。(C)NIR-II体内成像展示了健康小鼠和患肠癌小鼠在接触RNase-A@AuNCs时呈现出的差异。
3.5胃肠道成像
与骨组织不同,胃肠道由软组织构成,易受透射成像的高能辐射(如 X 射线)影响,因此诊断严重的胃肠道疾病时需要非侵入性、无辐射的替代方法。核糖核酸酶 - A 包封的RNase - A@AuNCs能够发射NIR-II的光,可以精准地分辨健康小鼠与肠道肿瘤小鼠,这一特性为胃肠道疾病或肿瘤的早期诊断提供了新的可能。借助高分辨率的 NIR-II 成像技术,能够清晰地观测到胃肠道内的直径为2.5mm的肿瘤结节(如图 6C 所示)。
3.6肿瘤成像
研究人员在乳腺癌小鼠模型上进行了一项监测肿瘤转移进程的实验。在对荷瘤小鼠注射谷胱甘肽稳定的AuNCs后,在 NIR-II 窗口进行成像。注射AuNCs后2.4s后,可见左腿血管成像,而右腿则需27.2s才获得更强的信号。在注射3.2min后,收集到了原发肿瘤与淋巴转移的信号(如图 7A(i - v))。AuNCs在肿瘤中的摄取量约为健康组织的 10 倍(图 7A(vi))。通过主成分分析叠加图像,血管、原发肿瘤以及淋巴转移均能够清晰辨别(图 7A(vii - xii))。
研究人员将磷酸胆碱配体共轭的 AuNCs(AuPC)用于 4T1 小鼠乳腺癌模型的 NIR-II 成像引导手术。给药后,AuPC 在肿瘤中均匀分布,其中一部分能穿透肿瘤间质液,并且借助NIR-II 成像精确勾勒肿瘤边缘,完全消除了肿瘤。
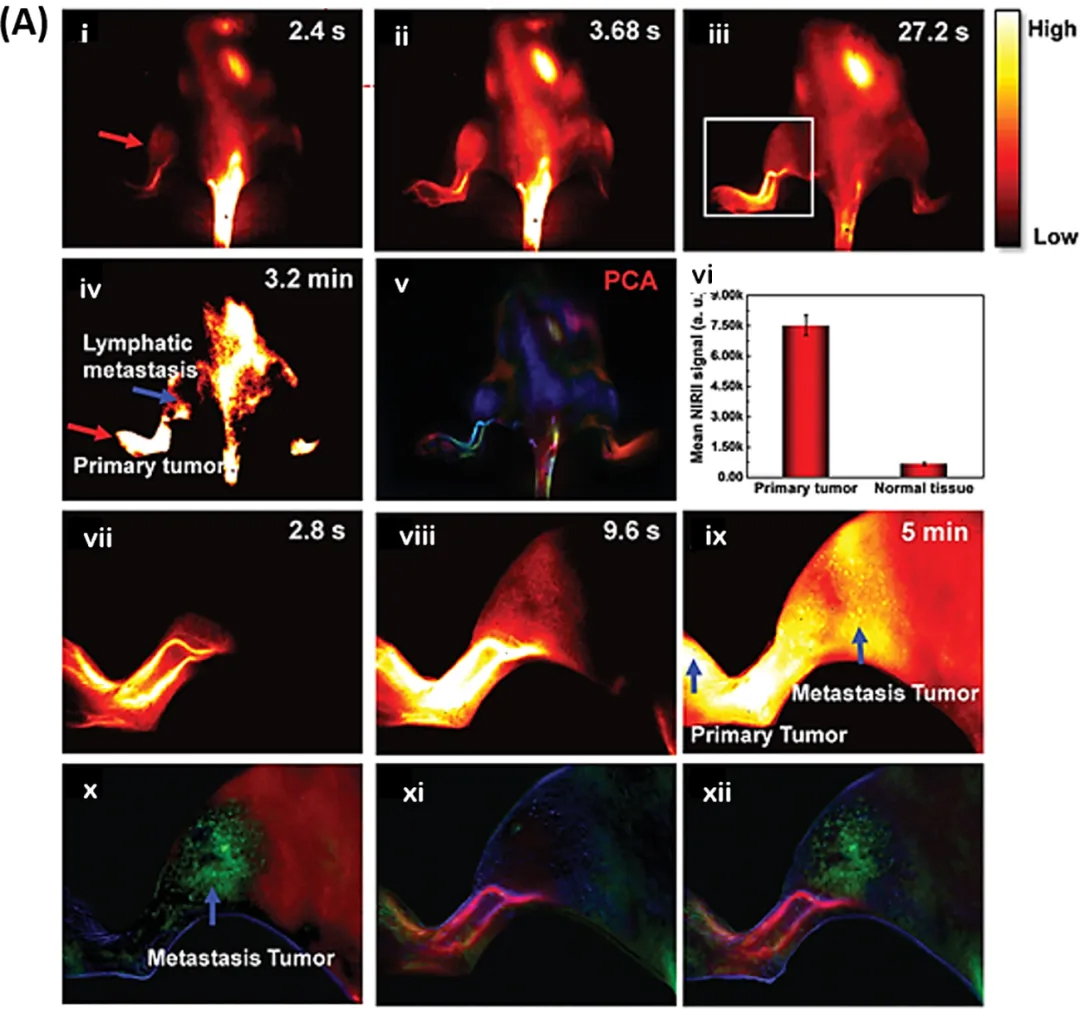
图 7. 肿瘤转移成像。(A)淋巴转移的动态成像(i - v),原发性肿瘤部位呈现出优于正常组织的NIR-II信号(vi)。肿瘤转移的进一步进展通过高分辨率成像(vii - ix)以及主成分分析(PCA)叠加图像得以展现,其中显示出了继发性肿瘤(绿色)(x - xii)。
3.7 生物标志物的分子成像
分子成像可以精确诊断和治疗各种疾病,通过识别单元对AuNCs进行功能化处理,能够达成对体内特定分子的靶向成像效果。这一特性在疾病的个性化诊断与治疗进程中具有极为重要的价值。研究人员使用聚多巴胺(PDA)对 GSH - AuNCs 进行包封,并负载亚甲基蓝(MB),可用于体内胃酸的选择性成像。在酸性条件下,AuNCs - PDA - MB可以释放MB ,同时还能激活在NIR - II波段的光致发光PL性能,可以用于胃溃疡疾病的诊断。
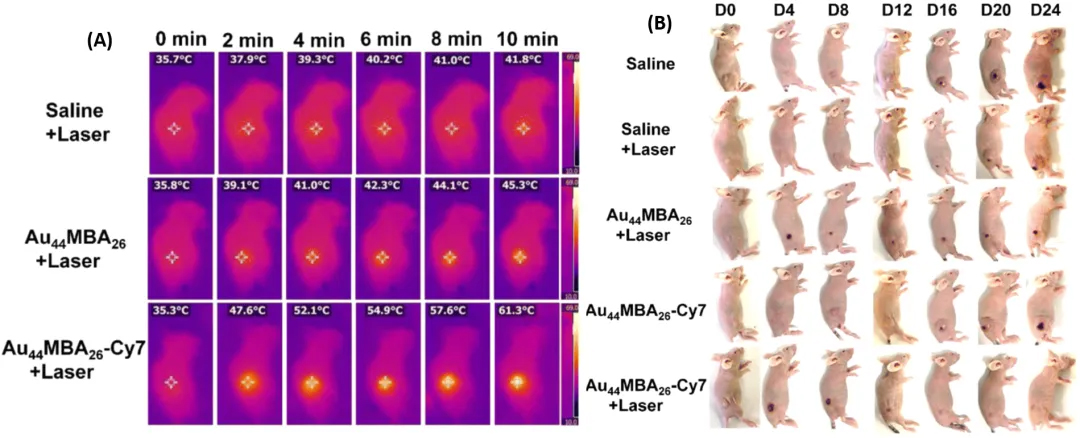
图 8. 将 Cy7 染料连接到发射NIR-II的 Au₄₄MBA₂₆上的光热疗法。体内光热治疗。(A)注射生理盐水、Au₄₄MBA₂₆ - Cy₇以及在 808nm 激光照射 10 分钟后的 Au₄₄MBA₂₆ - Cy₇的 4T1 荷瘤小鼠的代表性红外热成像图。(B)在各自治疗后不同天数的 4T1 荷瘤小鼠的照片。
讨论
随着人们对AuNC结构和光学性质之间相关性的深入了解,越来越多的AuNCs会被用NIR - II成像,这将极大推动肿瘤治疗领域的发展。未来,基于AuNCs构成的具有生物相容性和可生物降解的纳米结构,有望展现出新的光学特性、靶向递送能力和定时清除能力,可应用于更多的医疗领域。
参考文献:Nancy Sharma,Walaa Mohammads,Xavier Le Guével, Asifkhan Shanavas.Gold Nanoclusters as High Resolution NIR-II Theranostic Agents. REVIEW.
原文链接:https://pubs.acs.org/doi/10.1021/cbmi.4c00021